
期刊:Journal of Pharmaceutical Analysis
影响因子:8.8
伯豪产品服务:伯优单细胞测序组织保存液,单细胞转录组测序
导读
阿尔茨海默病(AD)是一种以认知功能障碍为特征的神经退行性疾病,已成为社会公共卫生问题,衰老是AD的主要发病风险之一。随着研究的不断深入,AD的病理表现从最初的淀粉样蛋白斑块沉积、神经原纤维缠结和神经元变性死亡,到现在的胶质细胞炎症,已被大量研究所证实,免疫功能的异常在AD发病机制中占据着举足轻重的地位。作为中枢神经系统(CNS)固有的免疫细胞,小胶质细胞在衰老和AD的发生发展中扮演着重要角色。研究衰老进程和AD进程中小胶质细胞的动态进展,有助于解析CNS中免疫环境的变化,可进一步揭示衰老与AD的发生机制,理清正常衰老与AD患者衰老的异同,对于AD的防治策略研发具有重要价值。
科学问题
由于AD发病机制尚未完全明确,在AD的临床治疗中,一方面不能早期、精确诊断,另一方面尚未有防治AD的理想药物,因此亟需了解AD进程中的生物学特征,为AD诊治研发奠定基础。
研究技术
10×单细胞转录组测序、ELISA、免疫荧光
引言
作者所在团队长期致力于阿尔茨海默病的机制研究,前期基于1240例AD和正常人群脑组织bulk测序数据鉴定出3种AD分子亚型,每种临床亚型有其独特的分子特征。亚型I基因表达集中在病毒感染、缺氧损伤和血管生成中。亚型II在突触病理上表现出异质性。亚型III是一个怀疑为家族性AD的风险亚型,涉及异常神经源性信号、胶质细胞分化和增殖。基于每个亚型的生物学特征,作者开发了AD的基因联合诊断模型,最高准确率为95%。
但是bulk转录组无法提供细胞异质性信息,单细胞测序技术的出现,可以对每个细胞进行独立分析,从而揭示细胞间的异质性,更有助于解析AD的生物学进程以便实现更精确的诊断。

研究内容
该研究基于单细胞RNA测序对5×FAD小鼠海马细胞进行分析,在AD进程中,小胶质细胞比例变化最为明显,血脑屏障(BBB)损伤可能是因素之一。在对小胶质细胞功能注释中发现免疫调节起着重要作用。CCL和MHC信号通路在衰老和AD海马细胞间通讯起着桥梁作用。APP和CSF信号通路驱动衰老向AD偏离。由于在细胞类型变化中小胶质细胞最为明显,作者对小胶质细胞进行了亚群细分,定义出10种小胶质细胞亚群,并分析了各自的功能特征。通过对小胶质细胞的自串扰分析发现,小胶质细胞内的细胞通讯强度随年龄增长而衰弱,其中CCL和CSF是小胶质细胞内交流的桥梁通路。
研究路线
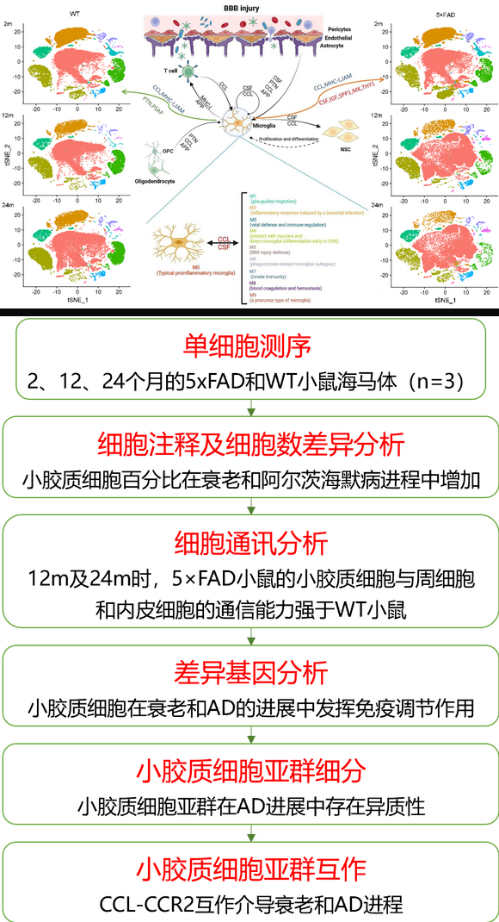
研究结果
1. 小胶质细胞的百分比在衰老和阿尔茨海默病进程中增加
作者从2、12和24月龄的5×FAD 及其WT小鼠海马中检测了158533个细胞,经无监督降维分析,分成10个细胞群:小胶质细胞、少突胶质细胞祖细胞、少突胶质细胞、星形胶质细胞、内皮细胞、神经元、神经干细胞、周细胞、T细胞和室管膜细胞。发现小胶质细胞变化最明显(Fig 1A-C)。并且用IF验证了小胶质细胞的增殖(Fig 1D)。ELISA检测发现Aβ的沉积与小胶质细胞增殖时间轴相对应(Fig 1E)。
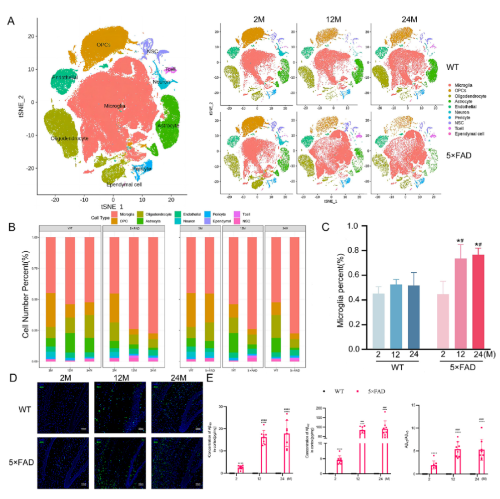
Fig 1:小胶质细胞数目在衰老和AD进展中变化最明显
2. 血脑屏障损伤可能增加衰老和AD进展中小胶质细胞的百分比
作者对小胶质细胞和其他细胞间的串扰进行了分析,发现小胶质细胞与星形胶质细胞的通讯强度恒定,在12月龄和24月龄时,5×FAD小鼠的小胶质细胞与周细胞和内皮细胞的通信能力强于WT小鼠(Fig 2A)。这提示小胶质细胞的异常变化可能会影响血脑屏障的功能和完整性。
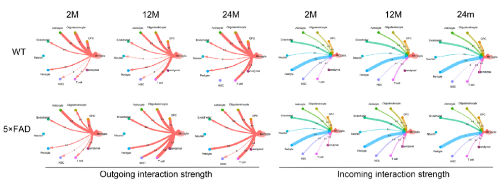
Fig 2:海马体各类细胞间的通讯
3.小胶质细胞的免疫调节在衰老和AD的进展中起着重要作用
作者比较了小胶质细胞在同一品系不同年龄和同一年龄匹配的不同品系小鼠中的基因表达情况(Fig 3A),鉴定出共表达基因(Fig 3B-D)并进行功能注释(Fig 3E)。在生物学进程中,排名Top20的通路有80%是免疫相关的。
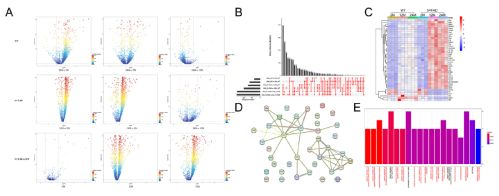
Fig 3:小胶质细胞在衰老和AD进展中发挥免疫调节作用
4.参与衰老和AD进展的小胶质细胞根据功能可分为10种独特的特征类型
作者对小胶质细胞亚群进行了细分,鉴定出10种小胶质细胞亚群。在WT小鼠中,M0亚型随着年龄的增长而逐渐增加,趋势较缓。而在5×FAD小鼠中,M0亚型比例增加显著,通过功能注释发现,M0亚型为经典的促炎亚型。除M0亚型外,作者还描述了其余亚型的比例变化趋势、功能注释和功能特征(Fig 4A,B,D)。为了研究血脑屏障损伤对小胶质细胞亚型的影响,作者还分析了血脑屏障相关细胞进入小胶质细胞亚型的信号流。受影响最大的三种小胶质细胞亚型分别为M9、M7和M0。

Fig 4:小胶质细胞亚群细分
5. 随着年龄的增长,小胶质细胞亚型间的相互作用强度变弱,AD患者的免疫细胞通讯则更为活跃
随着年龄和AD进程,小胶质细胞亚型也发生变化。小胶质细胞亚型之间的通信可能有助于更好地分析小胶质细胞的功能,作者观察了小胶质细胞亚型相互作用的强度(Fig 5A),在WT小鼠中,相互作用的强度随着年龄的增长而逐渐减弱。在5×FAD小鼠中,12月龄和24月龄时的相互作用强度低于2月龄;然而,与12月龄相比,24月龄时的交互作用强度略有升高。在2月龄时,WT小鼠的相互作用强度高于5×FAD,但在12月龄和24月龄时,WT的相互作用强度低于5×FAD(Fig 5A)。这提示了AD进程中小胶质细胞自交流的增强。
根据各亚型的整体相互作用强度(Fig 5B),M0、M2、M3、M6和M7在各组中均有较强的相互作用强度,是活性和功能上占优势的亚型。之后作者分析了亚型的互作网络(Fig 5C),并比较了WT和5×FAD小鼠中各亚型的相互作用强度疾病差异与衰老的差异(Fig 5D)。
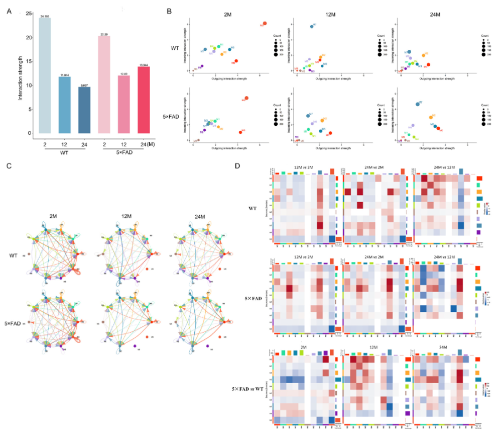
Fig 5:小胶质细胞亚群互作分析
6. CCL和CSF信号是小胶质细胞亚型之间沟通的基本桥梁
为了进一步探索衰老和AD过程中的特定信息流,作者比较了10个小胶质细胞亚型的交流强度(Fig 6)。CCL信号通路在WT小鼠24月龄时最强,在5×FAD小鼠12月龄时达到峰值(Fig 7A)。有趣的是,无论品系或年龄如何变化,CCL通路都表现出很强的相互作用强度(Fig 6和7B)。这说明CCL可能在小胶质细胞的自交流中起着主要作用。
在WT和5×FAD小鼠中,CSF信号的强度随着年龄的增长而增加。且Csf1的基因表达水平也随着年龄的增长而增加,并且在5×FAD小鼠中高于同月龄的WT小鼠(Fig 3C)。在小胶质细胞亚型中,M0亚型随着年龄的增长而增加最为显著(Fig 4B),CSF信号通路也主要由M0介导(Fig 8A)。对于每个小胶质细胞亚型的受配体对分析发现也支持这一点,CSF1-CSF1R表达量最高(Fig 8B)。
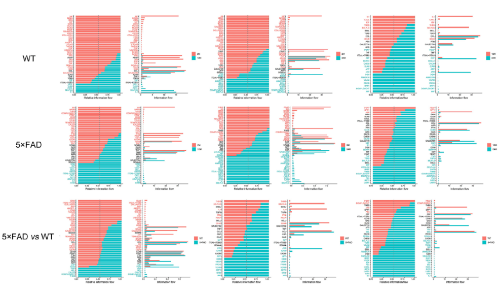
Fig 6:组间信号变化比较
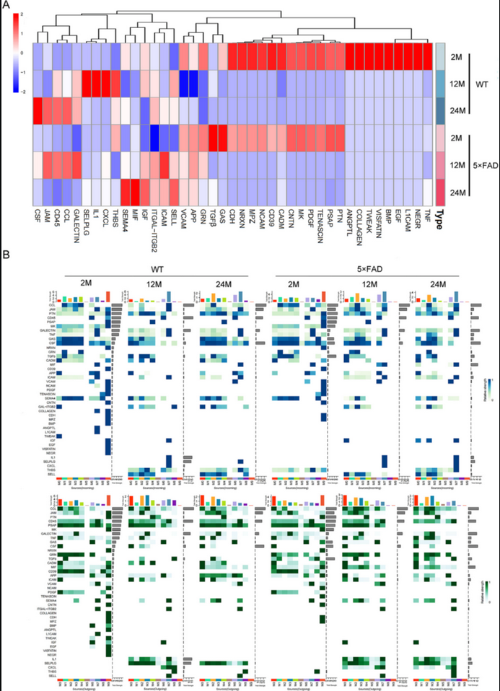
Fig 7:不同年龄段,小胶质细胞亚群通讯变化

Fig 8:小胶质细胞亚群中CCL和CSF通讯变化
研究结论
这项研究发现,在衰老小鼠和AD小鼠中,小胶质细胞的百分比增加,血脑屏障损伤可能导致这种增加。此外,在衰老和疾病进展过程中也发现了免疫核心调控基因。APP和CSF信号驱动5×FAD小鼠通过海马细胞间通讯偏离衰老轨迹转道AD发生。鉴定出10个小胶质细胞亚型和通信信号的基本桥接点(CCL和CSF)。这为探讨AD的发病机制提供了参考。
参考文献:
He Li, Tianyuan Ye, Xingyang Liu, Rui Guo, Xiuzhao Yang, Yangyi Li, Dongmei Qi, Yihua Wei, Yifan Zhu, Lei Wen, Xiaorui Cheng, The role of signaling crosstalk of microglia in hippocampus on progression of ageing and Alzheimer's disease, Journal of Pharmaceutical Analysis, 2023, ISSN 2095-1779, https://doi.org/10.1016/j.jpha.2023.05.008.
