主动脉瓣狭窄(AVS)是最常见的瓣膜性心脏病,由于主动脉瓣瓣叶增厚和钙化,导致主动脉瓣进行性狭窄,是心力衰竭和心血管死亡率增加的主要原因。omega-3多不饱和脂肪酸(n-3 PUFAs)在心血管预防方面具有有益作用,n-3 PUFAs作为合成特殊促分解介质的底物,在心血管疾病中具有抗炎、促分解和组织修饰特性。然而,n-3PUFAs和专门的促分解介质对AVS的影响尚不明确,Peter Sjovall研究团队对96例主动脉瓣置换术患者的三尖瓣主动脉瓣进行脂质组学和转录组学分析,并以Apoe-/-和C57BL/6J小鼠主动脉瓣线损伤为模型确定n-3PUFAs衍生的特殊促分解介质(SPMs)通过RvE1/ChemR23轴介导AVS进展的机制,提示n-3 PUFAs治疗可能为预防AVS提供新的治疗机会。
人主动脉瓣n-3不饱和脂肪酸含量
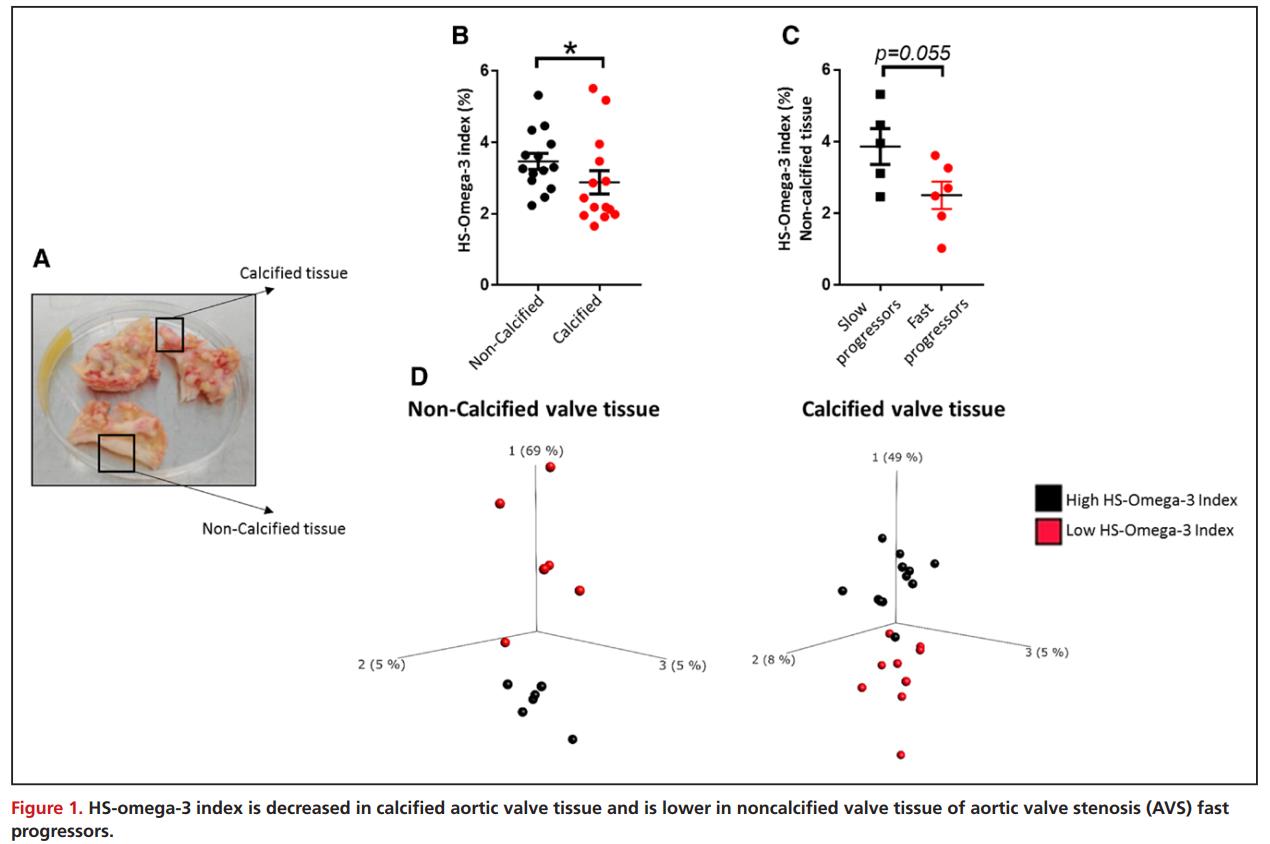
对21例非钙化主动脉瓣组织进行气相色谱分析测定人主动脉瓣中的脂肪酸含量,对比来自同一主动脉瓣的非钙化组织和钙化组织发现,非钙化部分的HS-omega-3指数(n-3 PUFA含量的整体测量)明显高于主动脉瓣钙化部分(图1B)。然而,与快速进展的AVS患者相比,有缓慢AVS进展史的患者在非钙化主动脉瓣区域显示更高的HSomega- 3(图1C)。此外,高HS -3指数和低HS-3指数患者的转录组主成分分析结果显示,在非钙化和钙化的人主动脉瓣组织中存在差异(图1D)。
Resolvins 和白三烯在钙化的主动脉瓣组织中失调
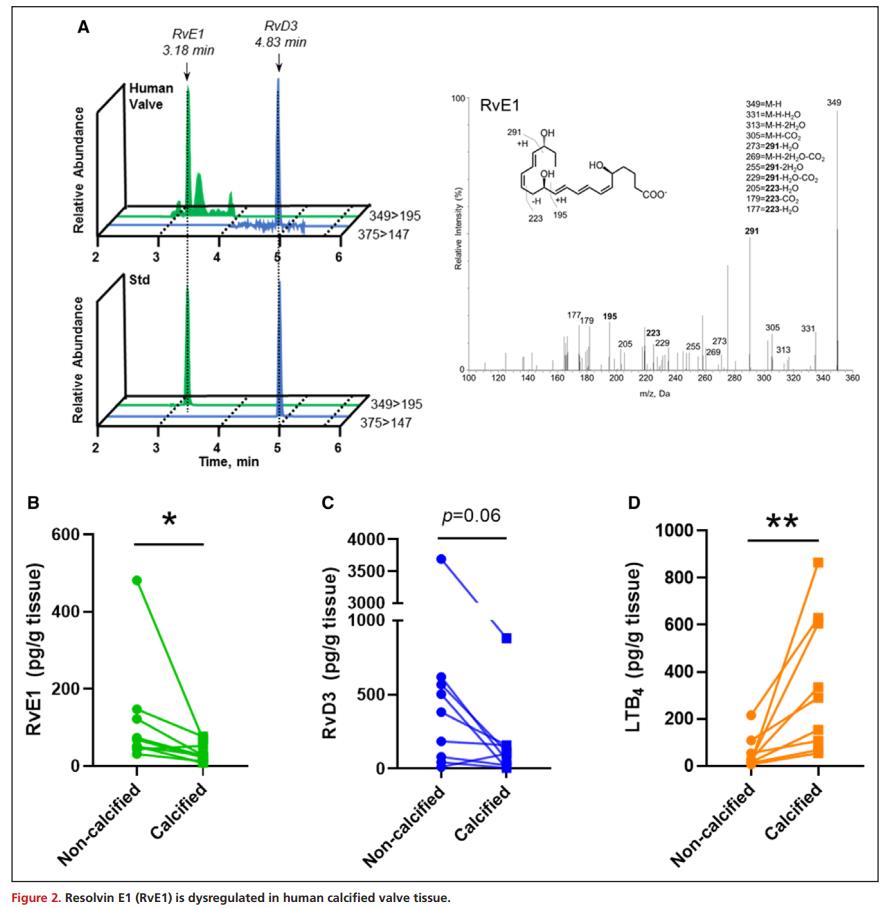
由于主动脉瓣脂肪酸含量的变化可能会改变下游脂质介质形成的底物可用性,采用液相色谱串联质谱技术进行靶向脂质介质的研究,在人非钙化和钙化瓣膜组织中鉴定了2个n-3 PUFA衍生的SPMs, DHA衍生的RvD3和EPA衍生的RvE1,多反应监测(MRM)定量结果显示,与非钙化组织相比,钙化组织中的RvE1水平显著降低(图2A和2B),且钙化组织中促炎的n-6 PUFA衍生脂质介质白三烯B4(LTB4)明显高于非钙化组织(图2D)。
RvE1受体ChemR23在人主动脉瓣中表达,RvE1在体外降低人瓣膜间质细胞钙化
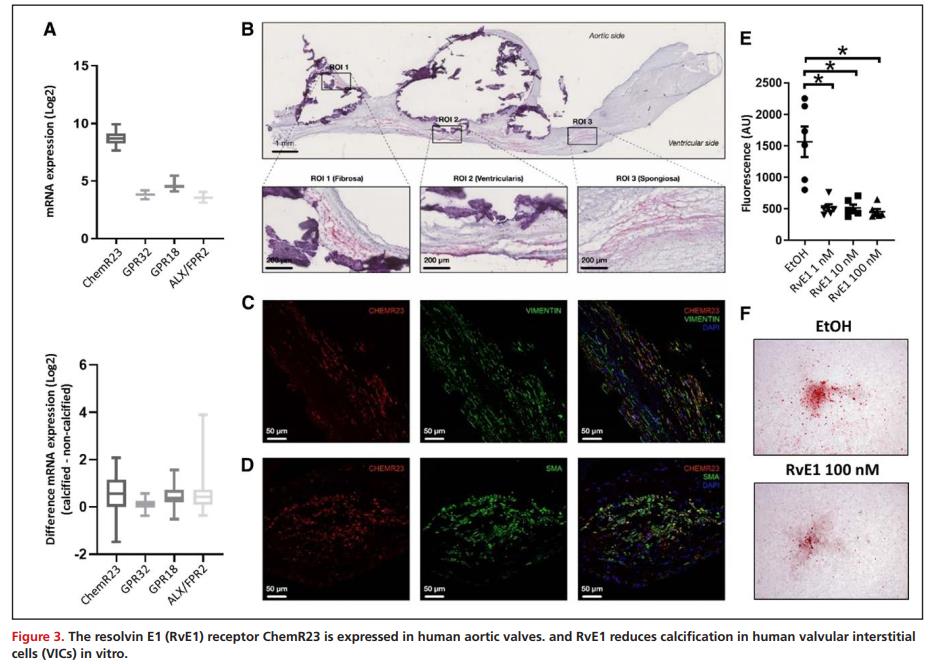
在64例人主动脉瓣的非钙化组织中研究了SPM受体ChemR23、GPR18、GPR32和ALX/FPR2的mRNA水平。基因表达分析显示,编码RvE1的ChemR23受体是人类主动脉瓣主要的SPM受体(图3A),此外,免疫组化检测到ChemR23蛋白表达广泛分布于人钙化和非钙化区域主动脉瓣的纤维层、海绵体层、心室层(图3B)。通过免疫荧光与瓣膜间质细胞(VIC)标记物平滑肌肌动蛋白和波形蛋白共定位(图3C-D)。考虑到ChemR23在VIC中的表达以及钙化瓣膜组织中RvE1水平的降低,接下来研究了RvE1对高磷酸盐介质诱导VIC钙化的影响,结果显示,与对照相比,RvE1显著降低了人VIC的钙化(图3E-F)。
Fat-1tg×Apoe−/−小鼠主动脉瓣瓣叶中n-3 PUFA浓度较高
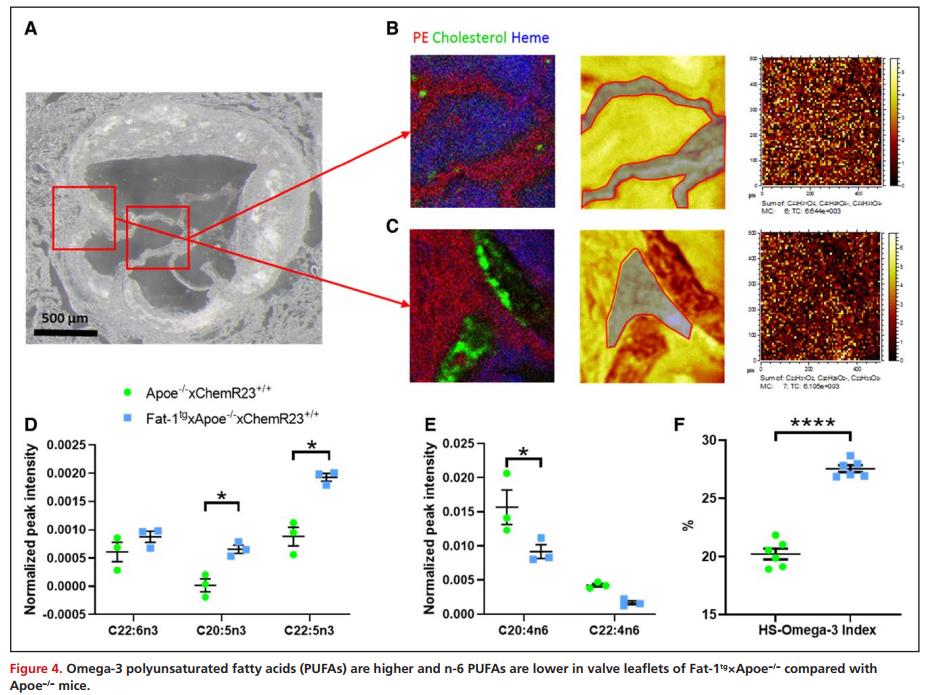
构建秀丽隐杆线虫基因 Fat-1tg (编码一种将n-6转化为n-3PUFAs的去饱和酶)在Apoe−/−小鼠中表达使得内源性产生n-3 PUFA,并借助飞行时间二次离子质谱对 Fat-1tg×Apoe−/−和Apoe−/−小鼠的主动脉瓣叶区域测量 n-3 PUFA 和 n-6 PUFA。光学显微镜观察主动脉根部,发现组织表面有磷脂酰乙醇胺,动脉粥样硬化斑块区域有胆固醇,无组织区域有血红素,表明有血液残留(图4A-C)。然后通过从专门对应于瓣叶区域的特定部位生成质谱来提取空间解析的脂肪酸数据(图4B-C)。对瓣叶中心区域所有质谱中脂肪酸信号强度的分析表明,与Apoe−/−小鼠相比,Fat-1tg×Apoe−/−小鼠n-3 PUFA(EPA,二十二碳五烯酸)的相对浓度显著升高,而 n-6 PUFA(花生四烯酸)的相对浓度显著降低(图4D-E),且Fat-1tg×Apoe−/−小鼠心室心肌HS-omega-3指数明显升高(图4F)。
Fat-1tg中止或ChemR23−/−会增加Apoe−/−小鼠的超声心动图进展
在 52、64 和 72 周龄分别评估经主动脉峰值速度 (Vmax) 和主动脉瓣尖瓣分离,提示Apoe−/−小鼠的 Vmax 随着年龄逐渐增加(图5A)。Fat-1tg×Apoe−/−小鼠表现出 Vmax 显著降低(图 5A),主动脉血管显著增加,与非转基因 Apoe−/−小鼠相比,72 周时瓣尖分离和左心室质量减少(图 5B)。根据对人主动脉瓣分析获得的结果,RvE1/ChemR23 轴被Apoe−/−模型中 ChemR23 的基因缺失而消除,以确定n-3PUFAs对主动脉瓣产生有益影响的机制。与Apoe−/−×ChemR23+/+小鼠相比,Apoe−/−×ChemR23−/−小鼠表现出 Vmax 显著增加、瓣尖分离减少,将 ChemR23 受体作为主动脉瓣保护的传感器(图5A-B)。为了确定增加的 n-3 PUFAs的有益作用是否通过ChemR23 转导,在Apoe−/−×ChemR23−/−小鼠中引入 Fat-1tg。在 Fat-1tg Apoe−/−(降低 Vmax 和增加主动脉瓣分离)中观察到的有益作用在 ChemR23−/−小鼠中完全消失(图 5A-B),表明n-3 PUFAs衍生的RvE1信号通过ChemR23在疾病进展发挥直接作用。Vmax与尖瓣分离呈负相关,提示Vmax 增加是尖瓣分离减少的结果。
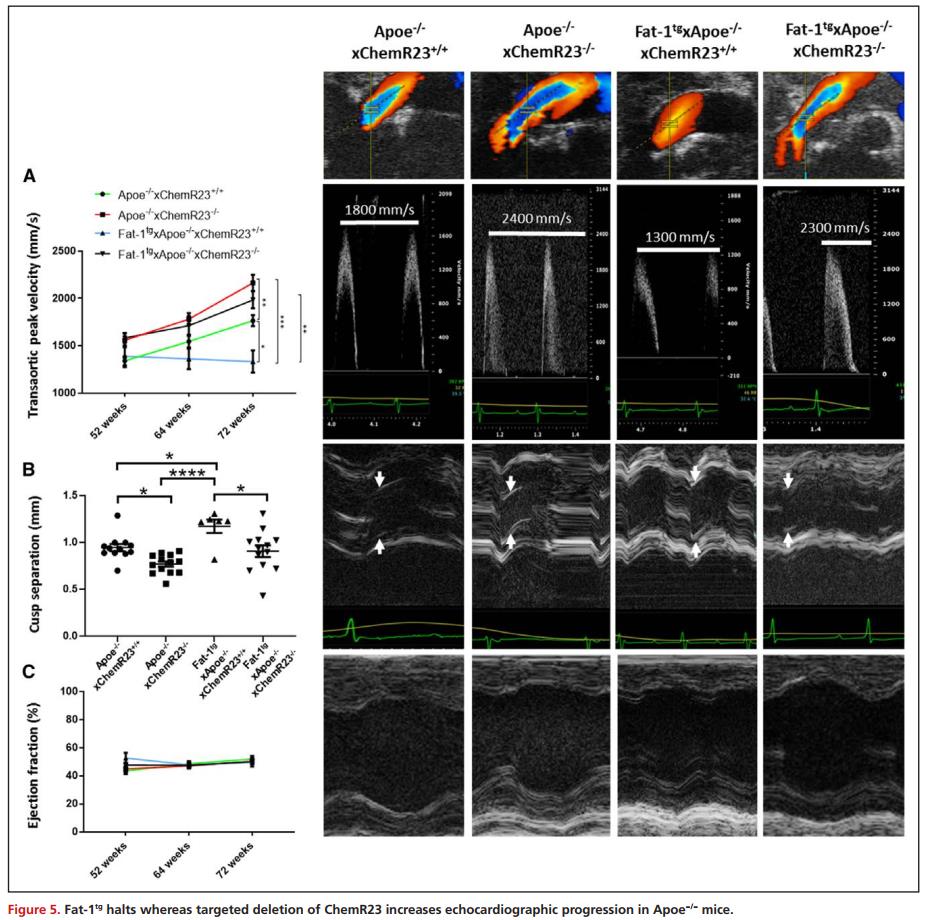
Fat-1tg 减少主动脉瓣叶面积,ChemR23-/-增加 Apoe-/-小鼠的主动脉瓣叶面积
形态学分析提示Fat-1tg通过 ChemR23 对主动脉瓣叶面积产生有益影响。与非转基因小鼠相比,Fat-1tg Apoe-/-小鼠的主动脉瓣叶面积减少。相反,与 Apoe-/-×ChemR23+/+小鼠相比,Apoe-/-×ChemR23-/-主动脉瓣瓣叶面积显著增加(图6A)。此外,在调整后的模型中,主动脉瓣瓣叶面积与主动脉瓣瓣叶厚度显著相关(图6B),与超声心动图测量的Vmax显著相关(图6C),与尖瓣分离显著相反(图6D)。定量变量的不显著偏相关提示基因型作为这些关联的预测因子(图6B-D)。
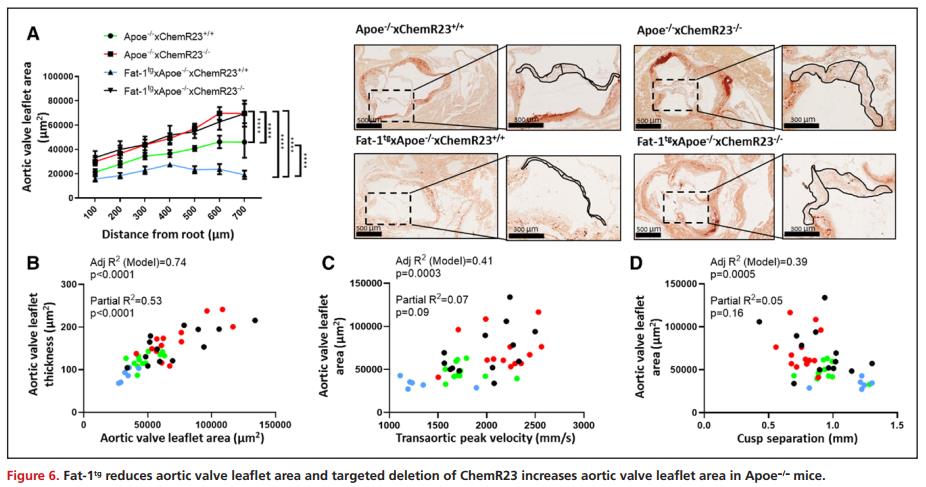
Fat-1tg 减少小叶钙化而ChemR23-/-增加Apoe-/-小鼠的小叶钙化
由于钙化是人AVS的主要成分,且与人类主动脉瓣非钙化区相比,钙化区n-3 PUFA含量和RvE1形成减少,因此通过茜素红染色随后分析4组小鼠主动脉瓣瓣叶钙化情况,结果表明,与 Apoe-/-ChemR23+/+小鼠相比,Fat-1tg Apoe-/-×ChemR23+/+小鼠的钙化显著降低;与 Apoe-/-×ChemR23+/+小鼠相比,Apoe-/-×ChemR23-/-小鼠无论 Fat-1tg存在与否都表现出显著更高的小叶钙化(图7A)。此外,小叶钙化与主动脉瓣小叶面积、Vmax 和瓣叶分离的相关性在调整后的模型中更为显著。
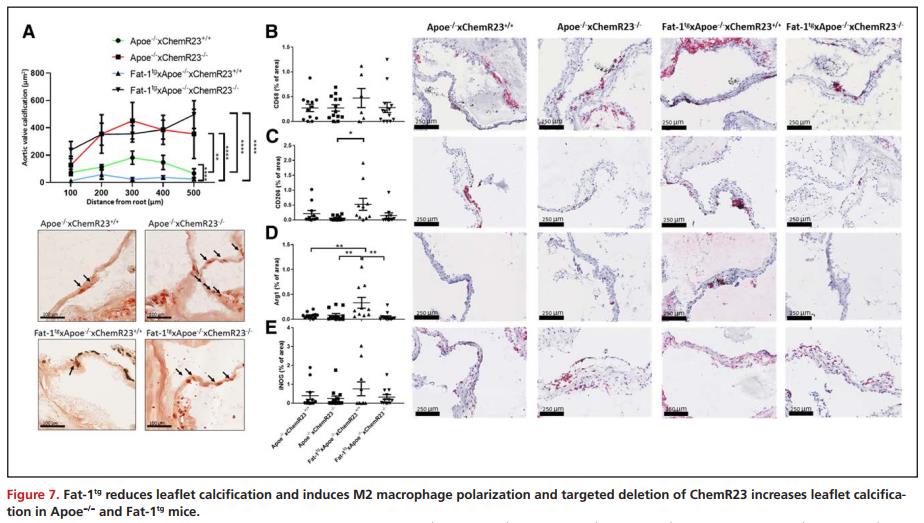
Fat-1tg诱导M2巨噬细胞极化,ChemR23与M2巨噬细胞标志物相关
因巨噬细胞代表狭窄瓣膜中的主要免疫细胞群,而且巨噬细胞极化是消除炎症的关键步骤,对小鼠主动脉瓣膜中的不同巨噬细胞标记物进行免疫组化。虽然含有 CD68 的小叶面积比例在各组之间无显著差异(图 7B),但在 Fat-1tg Apoe-/-小鼠中观察到 M2 巨噬细胞标志物 CD206 和精氨酸酶-1 的比例显著增加(图7C-D),且在ChemR23-/-的小鼠中丢失(图 7D)。
与小鼠瓣膜的研究结果一致,人主动脉瓣膜钙化和非钙化部分的ChemR23和CD206 mRNA水平之间存在强相关性,且ChemR23与M2巨噬细胞标志物CD163, CD209, CD200R1和血红素加氧酶1呈正相关。
ChemR23-/-导致主动脉瓣线损伤后主动脉瓣Vmax 升高和增厚增加
在高胆固醇血症的情况下,n-3 PUFAs通过ChemR23降低主动脉瓣阻塞、厚度和钙化,因此,使用血脂正常的 ChemR23+/+(C57BL/6J) 和 ChemR23-/-小鼠,并应用轻度损伤的主动脉瓣线损伤方案,建立第二个主动脉瓣疾病(AVD)模型。与Apoe-/-小鼠的结果一致,与 ChemR23+/+小鼠相比,ChemR23-/-小鼠在主动脉瓣损伤16 周后Vmax显著升高,组织形态分析显示,与ChemR23+/+小鼠相比,ChemR23-/-小鼠的主动脉瓣叶厚度显著增加。
小结
本研究首次揭示人主动脉瓣n-3 PUFAs含量的增加与更少的钙化和特定的转录模式相关,主动脉瓣n-3 PUFAs降低体内AVD,这在血流动力学、形态学标准及不同的小鼠模型中都一致。进一步破译了n-3 PUFA 衍生的 RvE1 及其受体 ChemR23 成为抑制 AVD 进展的关键轴,本研究的结果将 n-3 PUFA/RvE1/ChemR23 轴作为一种新的潜在治疗方案进行临床评估,以减缓 AVD 进展和改善AVD患者预后。
绘谱帮你测
近年来心血管病、糖尿病及肥胖、肝病、肾病、肿瘤、营养等多种疾病中观察到脂肪酸及其衍生物对机体的影响,通过检测游离脂肪酸和氧化脂质来表征机体的脂质代谢、内分泌功能状态,对探索疾病的发病机理、早期预警和治疗干预具有重要意义。麦特绘谱拥有成熟的基于LC-MS/MS的定性和定量平台能够检测多种生物样本中的70+种游离脂肪酸。此外,Q600、Q300全定量代谢组、宏代谢组等方法也包含60+种脂肪酸,详情欢迎咨询麦特绘谱热线400-867-2686。
参考文献
Gonzalo Artiach, Peter Sjovall, et al. Omega-3 Polyunsaturated Fatty Acids Decrease Aortic Valve Disease Through the Resolvin E1 and ChemR23 Axis. Circulation. 2020;142:776–789. DOI: 10.1161/CIRCULATIONAHA.119.041868.
原文下载,请长按识别下方二维码

精彩推荐
2. Physiol Rev | 脂肪酸在健康与疾病中的作用(上)
3. Physiol Rev | 脂肪酸受体在健康与疾病中的作用(下)
4. Nature Communications | 17项前瞻性研究揭示血液高水平n-3脂肪酸与低死亡风险相关
5. Circulation | 短链脂肪酸--丙酸盐预防高血压心血管损害
6. Circulation︱支链氨基酸代谢促进血栓形成新机制
7. Cell Metabolism︱丙酮酸-乳酸代谢轴异常诱发心肌肥大和心衰
8. Cell︱菌群代谢物-苯乙酰谷氨酰胺-心血管疾病又一推手
9. Nature Reviews Microbiology:菌群对心血管疾病的调节作用

