过氧化氢酶检测试剂盒(Catalase Assay Kit)是一种简单易行的通过显色反应来检测细胞、组织或其它样品中过氧化氢酶
(Catalase)活性的试剂盒。在过氧化氢相对比较充足的情况下,过氧化氢酶可以催化过氧化氢产生水和氧气。残余的过氧化氢在过氧化物酶(Peroxidase)的催化下可以氧化生色底物,产生红色的产物(N-(4-antipyryl)-3-chloro-5-sulfonate-p-benzoquinonemonoimine),最大吸收波长为520nm。用过氧化氢标准品,制作标准曲线,这样就可以计算出样品中的过氧化氢酶在单位时间单位体积内催化了多少量的过氧化氢转变为水和氧气,从而可以计算出样品中过氧化氢酶的酶活力。
过氧化氢酶分布非常广泛。在肝脏、肾脏和红细胞中,过氧化氢酶的水平非常高,是清除能导致氧化损伤的过氧化氢的主要场所。
过氧化氢酶的活性也可以用紫外分光光度计测定A240,但蛋白质或其它组份在A240附近都有比较强的吸收,会对测定产生严重干扰。因此,用紫外法测定过氧化氢酶的活性,比较适合纯化的过氧化氢酶。本试剂盒通过检测A520来测定过氧化物酶催化下由过氧化氢氧化生色底物产生的红色产物,受干扰的因素小,检测灵敏度高,可以检测出低达1U/ml的过氧化氢酶。
本试剂盒可以检测全血、红细胞裂解产物、血清、组织匀浆产物、细胞裂解产物等生物样品中的过氧化氢酶的活性。一个试剂盒共可以进行100次检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| S0051-1 | 过氧化氢酶检测缓冲液 | 60ml |
| S0051-2 | 过氧化氢 (约1M) | 5ml |
| S0051-3 | 过氧化氢酶反应终止液 | 50ml |
| S0051-4 | 显色底物 | 20ml |
| S0051-5 | 过氧化物酶 | 20μl |
| — | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。 过氧化氢酶检测缓冲液和过氧化氢酶反应终止液也可以4℃保存。
注意事项:
待测的过氧化氢酶样品,无论是纯的过氧化氢酶还是细胞或组织裂解产物,在4℃通常可以保存1周,-70℃可以长期保存,但-20℃保存后过氧化氢酶的活力会显著下降。
在检测过程中加入过氧化氢酶反应终止液后15分钟内需开始显色反应。
过氧化氢不太稳定,精确的过氧化氢浓度需参考本说明书中的方法进行测定。
如需对样品中的过氧化氢酶活力进行精确定量,需自备蛋白浓度测定试剂盒。例如可以选购生产的BCA蛋白浓度测定试剂盒(P0009/P0010/P0010S/P0011/P0012/P0012S)测定样品的蛋白浓度。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 试剂盒的准备工作:
a. 配制250mM过氧化氢溶液。本试剂盒提供的过氧化氢浓度约为1M。由于过氧化氢不是非常稳定,使用前需自行测定过氧化氢的实际浓度。把浓度约为1M的过氧化氢用本试剂盒提供的过氧化氢酶检测缓冲液稀释100倍,使过氧化氢的浓度约为10mM。测定A240。A240的测定可采用如下的任一方法:
(a)普通紫外分光光度计法:使用含比色皿架的紫外分光光度计、NanoDrop 2000C、NanoDrop Oneᶜ、QuickDrop等仪器,配套石英比色皿。确定比色皿光程(path length),一般为1cm。用比色皿检测的过氧化氢浓度最接近实际浓度。
(b)微量紫外分光光度计法:如NanoDrop 2000、NanoDrop One、QuickDrop、含超微量检测板µDrop Plate的Varioskan等仪器。确定光程:对于NanoDrop 2000、NanoDrop One等,需要取消“自动化光程”,此时光程一般为0.1cm;Varioskan的超微量检测板µDrop Plate的光程一般为0.05cm。具体的微量紫外分光光度计的光程请参考仪器参数。
(c)96孔紫外酶标仪法(须能检测240nm波长):根据96孔板的参数确定光程,一般200微升样品的光程为0.552cm (样品体积除以96孔单孔孔内横截面面积)。一般建议使用专用的96孔紫外检测板(如96孔UV板),如果没有紫外检测板,也可使用一般的96孔板,但由于为非紫外检测专用板,会有非常高的紫外吸收信号,所以需要设置含等量双蒸水的孔作为空白对照(一般200μl水在该类96孔板的A240在3.8左右),计算时须减去该空白对照。在使用非紫外检测专用板的情况下,由于96孔酶标仪在240nm的检测上限有限,建议将过氧化氢稀释至约10mM左右后再进行浓度测定。
注意:以上所有方法都需要设置等量双蒸水作为空白对照,并在计算时减去该空白对照。
浓度计算公式:c=A/(ε×b)。其中:c为样品浓度(单位为mol/L或M);A为吸光值;ε为波长依赖的摩尔消光系数(单位为L×mol-1×cm-1或M-1×cm-1),过氧化氢的摩尔消光系数为43.6M-1cm-1;b=光程(单位为cm)。
因此:过氧化氢浓度(M)=A240/(43.6×b);即:过氧化氢浓度(mM)=22.94 × A240/b
从而计算出本试剂盒提供的过氧化氢的实际浓度。
示例:将本试剂盒提供的约为1M的过氧化氢用双蒸水稀释100倍后,用96孔酶标仪及一般的96孔板进行检测,每孔200微升,每组3个平行。双蒸水对照组的平均A240为3.750,过氧化氢样品组的平均A240为3.974,差值为0.224,200微升样品的光程为0.552cm。代入公式,过氧化氢浓度(mM)=22.94×0.224/0.552=9.31,则实际本试剂盒提供的过氧化氢浓度为0.931M。
然后再根据实际的过氧化氢浓度配制250mM过氧化氢溶液。
b. 配制5mM过氧化氢溶液。根据测定得到的实际过氧化氢浓度配制5mM过氧化氢溶液。
c. 配制显色工作液。在冰浴上溶解显色底物,适当分装后再使用,尽量避免反复冻融。其它试剂放置在冰浴上备用。取适当量的过氧化物酶,按照1:1000的比例用显色底物稀释,配制成显色工作液。例如取5μl过氧化物酶,加入5ml显色底物,混匀即得到5ml显色工作液。
2. 样品的准备:
用适当的裂解液裂解细胞或组织(可以使用生产的Western及IP细胞裂解液(P0013)进行裂解。用本试剂盒提供的过氧化氢酶检测缓冲液稀释样品,裂解好的样品至少加入等体积的过氧化氢酶检测缓冲液进行稀释。具体的稀释倍数可以参考下表。
| 样品名称 | 蛋白浓度 | 检测时的样品使用量 | 反应时间 | A520 (空白对照-样品) |
| Blank | - | - | - | 1.17 (空白对照实测值) |
| Human red blood cell lysate | 0.2mg/ml | 4μl | 2min | 0.46 |
| Rat liver lysate | 0.3mg/ml | 7.5μl | 1min | 0.57 |
| Rat kidney lysate | 0.3mg/ml | 7.5μl | 3min | 0.42 |
| Rat spleen lysate | 0.3mg/ml | 7.5μl | 3min | 0.16 |
| Rat brain lysate | 0.3mg/ml | 15μl | 3min | 0.021 |
| HepG2 lysate | 2.0mg/ml | 3μl | 3min | 0.32 |
| Jurkat lysate | 2.0mg/ml | 3μl | 3min | 0.46 |
说明:表中的数据仅供参考,实际测定值由于检测体系的不同等可能与参考值之间存在20-50%的误差。对于相同的样品,同样的实验体系,测得的A520值和表1相比可能会有较大差异。如果实验体系不同,例如测得蛋白浓度的方法不同,使用的检测波长不同等,测得的A520值和我们提供的参考数值相比可能会有更大的差异。对于表中没有列出的样品,可以参考表中的类似样品进行检测,然后再根据检测结果适当调整蛋白浓度和样品使用量,或反应时间。通常对于完全未知的样品,可以对样品进行1、10、20和50倍稀释,然后各取10μl,反应1分钟。样品稀释后的浓度,最好可以使反应体系中的过氧化氢在反应1-5分钟后减少30-50%左右,这时的检测结果更加精确。
a. 细胞样品的准备。可以用Western及IP细胞裂解液(P0013)参考相应的说明裂解细胞样品。
b. 组织样品的准备。可以用Western及IP细胞裂解液(P0013)参考相应的说明裂解组织样品。
c. 全血样品的准备。收集全血(whole blood)至一抗凝管内,颠倒混匀。取100微升全血冻融一次,用过氧化氢酶检测缓冲液稀释1000倍后进行后续检测。
d. 红细胞裂解液的准备。用抗凝管收集血液,颠倒混匀。取至少500微升全血4℃ 2500g离心5分钟。弃上清,沉淀用冰冷的生理盐水(0.9%氯化钠)洗涤3次。用约5倍细胞体积的冰冷的去离子水,例如Milli-Q纯水,重悬细胞沉淀,冰浴10分钟。使用前用过氧化氢酶检测缓冲液稀释400倍后进行后续检测。
3. 标准曲线测定:
a. 取0、12.5、25、50或75微升配制好的5mM过氧化氢溶液至1.5ml或0.5ml塑料离心管中,分别加入过氧化氢酶检测缓冲液至最后体积为100微升,混匀,此时过氧化氢溶液浓度分别为0、0.625、1.25、2.5、3.75mM。如有需要,可以设置更高浓度的过氧化氢标准溶液。
b. 各取4微升,加入到96孔板中的一个孔内。加入200μl显色工作液。25℃至少孵育15分钟后测定A520,但孵育时间不宜超过45分钟。(注:本步骤可以和样品测定步骤中的最后一步同时进行。)
4. 样品测定:
| 空白对照 (blank) | 样品 (sample) | |
| 样品体积 | 0 μl | x μl |
| 过氧化氢酶检测缓冲液 | 40 μl | 40-x μl |
| 250mM过氧化氢溶液 | 10 μl | 10 μl |
a. 参考上表,取x微升(0-40微升)样品至1.5ml塑料离心管中,加入过氧化氢酶检测缓冲液至体积为40微升(即加入40-x微升过氧化氢酶检测缓冲液),混匀。再加入10微升250mM过氧化氢溶液,用移液器迅速混匀。参考表1,25℃反应1-5分钟。
b. 加入450微升过氧化氢酶反应终止液,颠倒混匀或Vortex混匀以终止反应。需在终止反应后15分钟内完成下面的步骤c和步骤d。
c. 在一洁净的塑料离心管内加入40微升过氧化氢酶检测缓冲液,再加入10微升已终止并混匀的上述反应体系,混匀。
d. 从上一步骤的50微升体系中取10微升加入到96孔板中的一个孔内。加入200微升显色工作液。
e. 25℃至少孵育15分钟后测定A520,但孵育时间不宜超过45分钟。
5. 样品中过氧化氢酶酶活力的计算:
a. 计算出标准曲线。A520=k[过氧化氢微摩尔数]+b,由标准曲线计算出k和b的值。标准曲线的检测效果请参考图1。
例如本说明书中的标准曲线公式为:y=70.281x +0.06,即k=70.281,b=0.06,则A520=70.281 × [过氧化氢微摩尔数]+0.06。
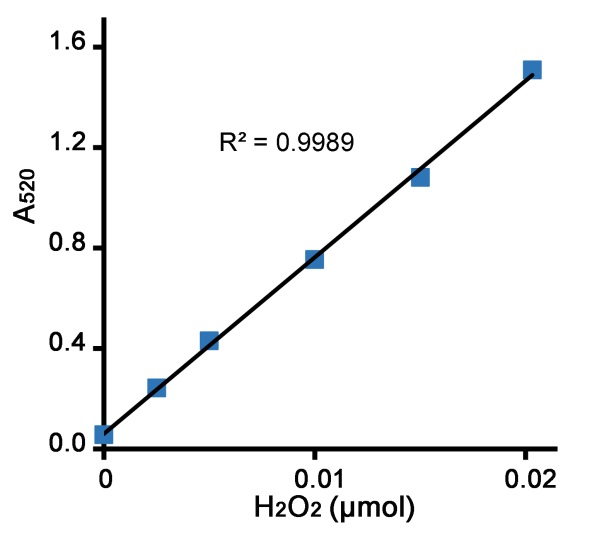
图1. 本过氧化氢酶检测试剂盒的标准曲线效果图。配制好的过氧化氢标准溶液(0、0.625、1.25、2.5、3.75、5mM)各取4微升,用本试剂盒进行检测,对应的微摩尔数分别为0、0.0025、0.005、0.01、0.015、0.02微摩尔。不同的检测条件下,实际读数会因检测仪器等的不同而存在差异,图中数据仅供参考。
b. 计算出样品中残余的过氧化氢微摩尔数。
残余过氧化氢微摩尔数=(A520-b)/k
c. 过氧化氢酶酶活力单位的定义:1个酶活力单位(1 unit)在25℃,pH7.0的条件下,在1分钟内可以催化分解1微摩尔过氧化氢。
d1. 对于细胞或组织样品的过氧化氢酶活力计算:
[样品过氧化氢酶酶活力]=[消耗过氧化氢微摩尔数] × [稀释倍数]/([反应分钟数] × [样品体积] × [蛋白浓度])
[样品过氧化氢酶酶活力]的单位为units/mg蛋白
[消耗过氧化氢微摩尔数]=[空白对照残余过氧化氢微摩尔数]-[样品残余过氧化氢微摩尔数]
[稀释倍数]=250
[反应分钟数]即为实际的反应分钟数
[样品体积]为表2中的X微升,以毫升来表示即为X/1000毫升。
[蛋白浓度]为取X微升样品时,样品中的蛋白浓度,单位为mg/ml。
d2. 对于血浆等液体样品的过氧化氢酶活力计算:
[样品过氧化氢酶酶活力]=[消耗过氧化氢微摩尔数] X[稀释倍数]/([反应分钟数]X[样品体积])
[样品过氧化氢酶酶活力]的单位为units/ml样品
